Nu när snön legat några dagar har kaoset bedarrat och trafiken flyter mer eller mindre som vanligt igen. Men det är ändå en svår säsong för oss cyklister. Vinterröjningen av cykelbanorna är nedprioriterad till icke-existens, vilket kanske inte är så förvånande i en stad där cykelbanor tills nyligen var ett i det närmaste okänt begrepp. Det betyder dock att som cyklist tvingas man ut och slåss med bilarna på gator som är smalare än vanligt på grund av av snön längs kanterna.
Men det betyder oxå att man tvingas stå ut med de oändliga mängder salt man sprider ut för att hålla vägarna rena och allt vad det betyder av korrosion. Korrosion är en mycket komplicerad process (som är ett aktivt forskningsområde inom fysikalisk kemi), som kostar miljarder årligen i skador på bilar, broar och cyklar. På min cykel har vevlagret drabbats och jag hoppas att det skall hålla vintern ut så jag kan skaffa nytt till våren istället. Trots att saltet är irriterande (för att inte tala om att slasket är ett sår i det fina vintervita) så finns det ju några intressanta vetenskapliga aspekter av det hela.
Anledningen till att man använder salt är ju att en saltlösning (i vatten) fryser vid lägre temperatur än en ren vattenlösning. I fasdiagrammet nedan kan man se att med en blandning av vanligt bordssalt och vatten kan man sänka fryspunkten ner till -21,1°C vid en lösning med 23,3% salt. Detta kallas den eutektiska punkten.
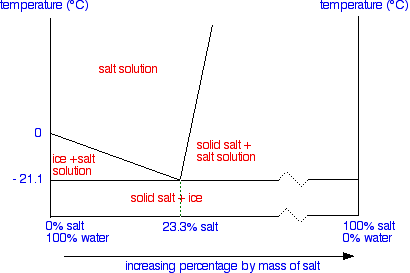 |
| Fasdiagram hos NaCl i vatten. Bild från ChemGuide. |
Anledningen till att fryspunkten sjunker är att det blir en skillnad mellan den kemiska potentialen i den lösta och i den fasta formen av saltet. Kemisk potential är ett mått på hur mycket energi som krävs för att introducera mer molekyler till en form. En intressant aspekt är att vid låga koncetrationer av av det lösta ämnet så spelar det inte någon roll vilket ämne det är… För varje mol / kg vattenlösning sänks fryspunkten 1,86 grader. Vid högre koncentrationer är det dock skillnad mellan olika lösta ämnen. Min chef berättade att i Warszawa har man nu börjat att använda en del kalciumklorid på vägarna i stället för natriumklorid som är det vanligaste. Anledningen är att en CaCl2-lösning har lägre temperatur vid den eutektiska punkten än en NaCl-lösning. Ned till ca -50°C kan den hållas flytande.
 |
| Fasdiagram för en lösning av CaCl2 i vatten. Punkterna B och C markerar fasövergångar till andra saltstrukturer. Bild från phasediagram.dk. |
Efter denna saltade utläggning kan naturligtvis dagens ord bara bli sól – salt.